作者:四月的雨 来源:药渡
概述
1、研究目的
原料-辅料相互作用研究是制剂开发前的一个重要阶段。原料和辅料之间潜在的物理、化学以及生物相互作用会影响制剂在体内的吸收以及安全性。
加快药物开发进程和优化剂型稳定性是药物研发的两大目标。实现这些目标的一个关键步骤就是在药物处方前研究时确定最佳的处方组成。
2、原辅料相容性实验重要性
(1)可以最大限度地提高剂型的稳定性。药物与辅料之间的物理或化学相互作用会影响药物的生物利用度和稳定性;
(2)可以帮助我们在确定最终剂型之前了解可能发生的反应;
(3)原辅料相容性对于IND申报必不可少。目前美国食品药品监督管理局已经强制要求在批准任何新药之前需要提交原辅料相容性数据;
(4)可以确定最终可用于处方的辅料列表。
原料-辅料相互作用途径
1、物理相互作用
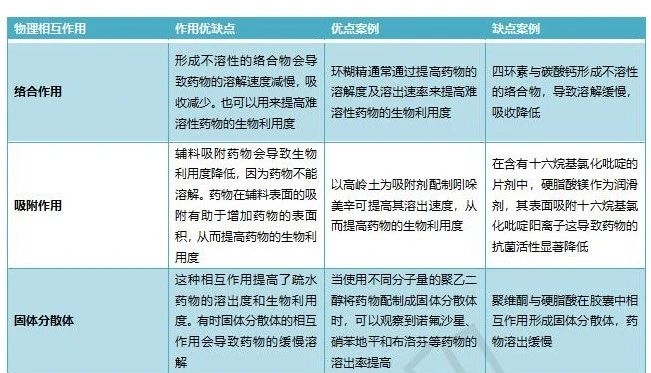
物理相互作用在剂型中非常常见,也很难检测到。物理相互作用可能涉及化学变化,也可能不涉及化学变化。物理相互作用包括络合、吸附、晶型变化等。物理相互作用可能对产品性能有利,也可能有害。
表1 物理相互作用
2、化学相互作用
原料与辅料、辅料与辅料、辅料杂质与辅料以及原料以及辅料杂质间的相互反应形成不稳定的化合物即化学相互作用。通常化学相互作用对制剂都是有害的,因此通常必须避免这种相互作用。原辅料相容性中常见的化学反应如下:
(1)水解反应
含有酯类、酰胺类、内酯等官能团的药物易发生水解反应。这可能是最常见的药物降解方式,因为绝大部分药物中存在这样的基团。
(2)氧化反应
氧化降解是仅次于水解的一种分解方式。氧、重金属离子和光照都能催化氧化反应,导致自由基的形成。自由基与氧气反应生成过氧基团,过氧基团又与可氧化化合物反应生成额外的自由基,从而进一步推动反应的发生。醛、醇、酚、生物碱、不饱和脂肪以及油等都容易发生氧化反应。
(3)异构化作用
异构化是指将一种化学物质转化为它的光学或几何异构体。异构体可能具有不同的药理或毒理学性质。例如,左旋肾上腺素(L)的活性是右旋肾上腺素(D)的15-20倍。
(4)光解反应
氧化还原、环变和聚合等反应可以在光下被催化或加速。
(5)聚合反应
分子间反应可能导致二聚体和更高分子量的化学物质。例如氨苄青霉素的溶液逐渐形成二聚体、三聚体,并最终形成聚合物降解产物。
(6)美拉德反应
乳糖是固体口服片剂中常用的辅料之一,理化性质比较稳定。但是乳糖是一种还原性二糖,它可以与含有氨基的药物或辅料发生美拉德反应。所以使用乳糖辅料时,应先注意所使用的其余辅料或者药物是否含有氨基。
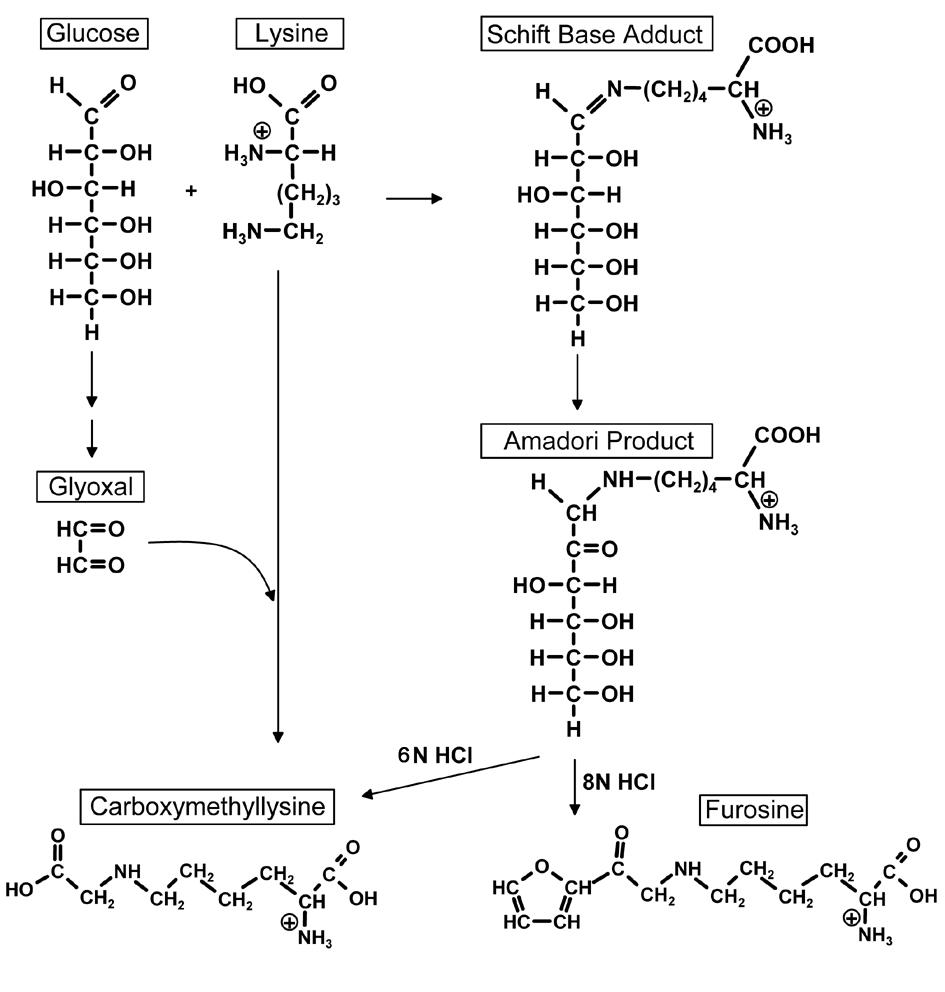
图1 美拉德反应
3、生物相互作用
生物相互作用是给药后药物活性成分与辅料体内的相互作用。药物与体液的相互作用会影响吸收速度。当辅料与活性药物成分一起给药时,所有辅料都以生理方式相互作用,如肠溶衣过早破裂、一些辅料导致胃肠道动力增强等都属于生物相互作用。生物相互作用主要影响药物在体内的安全性及有效性。
原辅料相容性指导原则
目前各国并没有明确的原辅料指导原则,下面笔者介绍几个可以作为参照的文件,具体的试验设计还需要根据自己的项目具体情况进行设计。
1、《药用辅料与药物相容性研究指导原则》(征求意见稿)
下面为该指导原则的实验方法以及决策树:
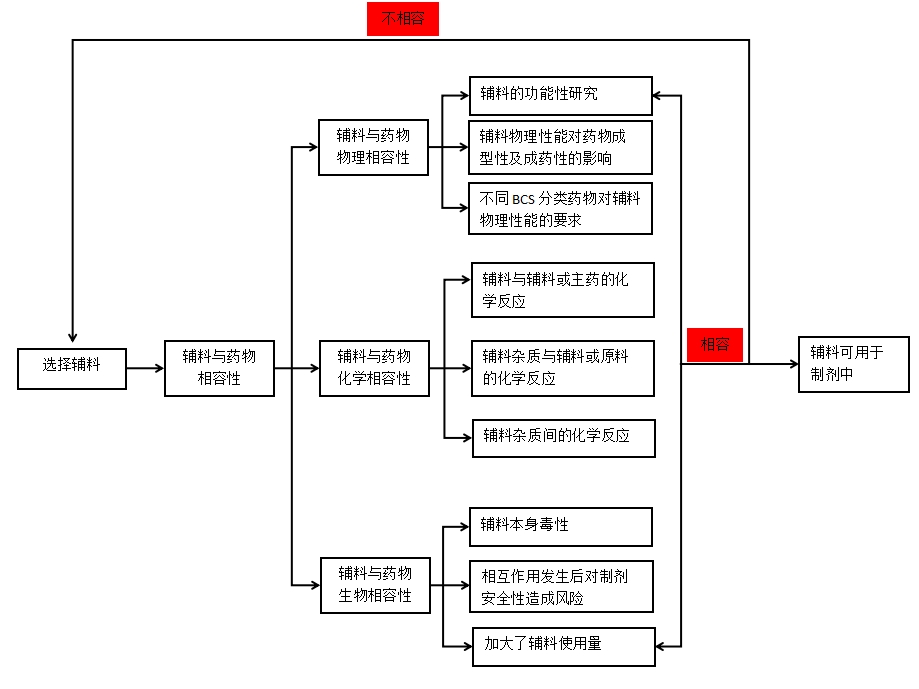
图2 原辅料相容性决策树
药用辅料与药物化学相容性的通常试验研究方法如下:
将处方研究中拟用的各种药用辅料逐一与药物活性物质进行物理混合,在高温高湿强光条件下进行加速试验,试验条件的选择应能反应制剂的关键质量属性指标,试验中主药和辅料成分的比例应能够反应制剂处方配比的变化,例如依据处方中不同功能辅料配比预混合筛选后,设置主药与辅料比为1:5(稀释剂)、3:1(粘合剂、崩解剂)、5:1(润滑剂)、10:1(着色剂)的比例混合。取一定量,在高温、高湿、光照下放样,研究其在上述条件下是否产生新的杂质。
2、《化学药物制剂研究基本技术指导原则》
对于缺乏相关研究数据的,可考虑进行相容性研究。例如口服固体制剂,可选若干种辅料,若辅料用量较大的(如稀释剂等),可按主药:辅料=1:5的比例混合,若用量较小的(如润滑剂等),可按主药:辅料=20:1的比例混合,取一定量,参照药物稳定性指导原则中影响因素的实验方法或其他适宜的实验方法,重点考察性状、含量、有关物质等等,必要时,可用原料药和辅料分别做平行对照实验,以判别是原料药本身的变化还是辅料的影响。
如处方中使用了与药物有相互作用的辅料,需要用实验数据证明处方的合理性。对某些具有生理活性的辅料、超出常规用量且无文献支持的辅料、改变给药途径的辅料,需进行必要的安全性试验。
3、ICH 指导原则 Q8(R2)
ICH指导原则提出在制剂研发开始阶段需要进行原辅料相容性试验。
4、Chemistry Review of Question-based Review (QbR) Submissions
FDA发布的《Chemistry Review of Question-based Review (QbR) Submissions》ATTACHMENT 2: QbR QUESTIONS - DRUG PRODUCT (CHEMISTRY)第9部分提到:“What evidence supports excipient-drug substance compatibility and if applicable,excipient-excipient compatibility?”。该指导原则需要我们通过原辅料相容性实验来证明我们所选用的辅料是适用的。
综合几个指导原则,绝大多数项目原辅料相容性试验可以说是我们处方前研究中必做的,下面我们一起探讨如何做好一个原辅料相容性试验。
原辅料相容性试验
由上述的指导原则可看出,中国的指导原则相对详细,其中介绍了主药与辅料的配比关系、重点考察内容等,而国外的指导原则只是粗略的说明了需要做原辅料相容性试验。由于目前并没有一份权威的指导原则,所以设计试验时我们需要根据自己的项目实际情况以及目前已有的一些指导原则作为参考,进行我们的实验设计,试验需根据不同的项目进行灵活的变化。
原辅料相容性试验之前,我们需要对我们项目中可能会用到的辅料进行统计,这需要我们根据我们处方前文献调研及自身经验进行抉择。确定辅料后,我们一般将原料与辅料配制成二元的混合物(比例可参照各指导原则),原则上不建议配置成多元的混合物,并且单独的原料以及单独的辅料作为对照,要与混合物同时放样。
对于原辅料相容性试验的考察条件,我们一般会考察三个方向,即高温、光照以及高湿条件。高温试验考察条件一般要高于加速条件,可选择50℃或60℃。高湿试验一般选择75%RH或92.5%RH。光照试验指导原则规定总照度不低于1.2×106Lux•hr、近紫外能量不低于200w•hr/m2。对于试验取样时间点,可选择0、7、14天或0、10、30天。
取样后我们需要观察评价样品变化。首先需要测量我们的样品增重以及失重,在光照以及高温下我们的样品有无颜色变化等,最后送检有关物质。
总结
原料-辅料相互作用是制剂开发中的重要问题。在处方前研究中选择合适的辅料是重要的。在药物研发和商业化后遇到的许多稳定性问题都是因为前期对原料-辅料相互作用研究的不透彻,缺乏对化学和物理相互作用的复杂性的认识所导致的,对原料-辅料相互作用的研究是开发稳定和高质量制剂的必要前提。
参考资料:
[1]Interactions and Incompatibilities of Pharmaceutical Excipients with Active Pharmaceutical Ingredients: A Comprehensive Review. 2010.
[2] Serajuddin A , Thakur A B , Ghoshal R N , et al. Selection of solid dosage form composition through drug–excipient compatibility testing[J]. Journal of Pharmaceutical Sciences, 1999, 88(7):696-704.
[3] Drug-Excipient compatibility studies: First step for dosage form development
[4] 《化学药物制剂研究基本技术指导原则》
[5] 《ICH 指导原则 Q8(R2)》
[6] 《Chemistry Review of Question-based Review (QbR) Submissions》